Anvisa aprova pela primeira vez registro de remédio à base de maconha
A Anvisa (Agência Nacional de Vigilância Sanitária) concedeu pela primeira vez o registro a um medicamento à base de cannabis sativa, a maconha, no país. Chamado Mevatyl, o produto é indicado para o tratamento de adultos que tenham espasmos relacionados à esclerose múltipla. O registro na Anvisa é um documento obrigatório para que qualquer medicamento possa ser comercializado no Brasil.
As regras para aprovar medicamentos à base de maconha foram aprovadas pela Anvisa em novembro do ano passado. O Mevatyl, conhecido fora do Brasil como Sativex, é aprovado em 28 países, entre eles, Canadá, Estados Unidos, Alemanha e Dinamarca. O remédio tem a seguinte composição: tetraidrocanabinol (THC), 27 mg/mL+canabidiol(CBD), 25 mg/mL)
- Leia Também
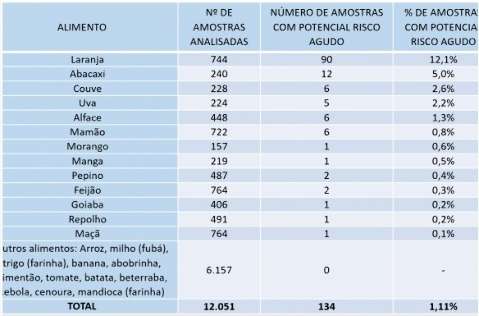
- Anvisa indica que laranja tem maior risco de contaminação por agrotóxico
- Falta de registro pela Anvisa não deve comprometer questão de medicamentos
Conforme dados de estudos clínicos feitos com o Mevatyl, a ocorrência de dependência com o seu uso é improvável. O produto será comercializado com tarja preta e rotulagem dirá que o uso ficará sujeito a prescrição médica por meio de notificação de receita A e de Termo de Consentimento Informado ao Paciente.
O medicamento é da britânica GW Pharma Limited, e a detentora do registro do medicamento no Brasil é a empresa Beaufour Ipsen Farmacêutica Ltda., localizada em São Paulo (SP).
Importação – Para a compra de outros medicamentos à base de maconha, a Anvisa tem o seguinte procedimento: primeiramente, o paciente preenche um formulário contendo os dados do paciente, o sintoma a ser tratado e o nome do produto. O documento passará por avaliação, e se aprovado, a importação pode ser feita por bagagem acompanhada, por remessa expressa ou por registro do Licenciamento de Importação.